Descripciónde la tabla periódica: elementos chilos PDF

| Title | Descripciónde la tabla periódica: elementos chilos |
|---|---|
| Course | Quimica fisica |
| Institution | Universidad Pedagógica Nacional (México) |
| Pages | 11 |
| File Size | 727.4 KB |
| File Type | |
| Total Downloads | 102 |
| Total Views | 132 |
Summary
Nombre del articulista
(Fecha).
Título del artículo.
Título de la publicación.
Número de la publicación.
Lugar, Editorial.
Número de páginas consultadas.
Ejemplo. Mulia, J. (2014, septiembre-diciembre). Coloides Asimétricos. Boletín. Investig...
Description
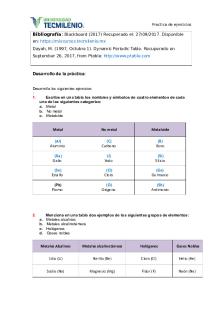
CONCEPTO DE TABLA PERIÓDICA La tabla periódica de los elementos es una disposición de los elementos químicos en forma ordenada y organizada basada principalmente en su número atómico (número de protones), así como en sus propiedades físicas y químicas.
SÍMBOLO QUÍMICO El símbolo es la representación gráfica y abreviada del nombre de un elemento químico, lo cual ha sido aceptado en todo el mundo. Este símbolo está formado por una letra mayúscula, pudiendo estar acompañada por una segunda letra minúscula, en caso de que la primera letra ya hubiese sido asignada a otro elemento Ejemplo Calcio Ca, Sodio Na, Bromo Br. Litio Li
DESCRIPCIÓN DE LA TABLA PERIODICA Los 118 elementos que forman la Tabla periódica se distribuyen en columnas (denominadas “grupo” o “familia”) y filas (denominadas “periodos”) Grupo o Familia, es el ordenamiento de los elementos en columna. Estos elementos presentan similar disposición de sus electrones externos; de allí que forman familias de elementos con propiedades químicas similares. Anteriormente los grupos o familias se dividían en A y B . Existen 8 grupos A que se conocen como elementos representativos, y 8 grupos B, que se conocen como elementos de transición y transición interna. En la actualidad los grupos se numeran del 1 al 18 con números arábigos, de acuerdo a la modificación que hizo la unión internacional de química pura y aplicada (IUPAC por sus siglas en ingles) en noviembre de 2016.
GRUPOS
GRUPO O FAMILIA “A” Metales Alcalinos Metales Alcalinotérreos Familia Del Boro Familia Del Carbono Familia Del Nitrógeno Familia
Del Oxigeno O Calcógenos
Familia De Los Halógenos Familia De Los Gases Nobles
GRUPO O FAMILIA “B”
FAMILIA DEL ESCANDIO FAMILIA DEL TITANIO FAMILIA DEL VANADIO FAMILIA DEL CROMO FAMILIA DEL MANGANESO FAMILIA DEL HIERRO FAMILIA DEL COBRE FAMILIA DEL ZINC
NÚMERO DEL GRUPO O FAMILIA “A”
NÚMERO DEL GRUPO (Numeración Actual)
IA II A III A IV A V A VI A
1 2
VI IA VI II
1 7 1 8
NÚMERO DEL GRUPO O FAMILIA IIIB IVB VB VIB VIIB VIII B IB IIB
En el grupo 3 (III B) se encuentran los Lantánidos y Actínidos
1 3 1 4 1 5 1 6
NÚMERO DEL GRUPO (Numeración Actual) 3 4 5 6 7 8,9 Y 10 11 12
Período, es el ordenamiento de los elementos en línea horizontal. Estos elementos se caracterizan pues sus propiedades físicas y químicas varían gradualmente, pero tienen la misma cantidad de niveles en su estructura atómica. La tabla periódica tiene 7 periodos cortos (1 al 3), y largos (4 al 7) para numerarlos se utilizan números arábigos.
PERÍODOS
Otra forma de clasificación Agrupa a los elementos en metales, no metales y metaloides Metales
No Metales Semimetal O Metaloide
PROPIEDADES DE LOS METALES Y NO METALES METALES Todos sólidos a temperatura ambiente excepto el Hg, Ga y Cs
Elevada conductividad eléctrica Alta conductividad térmica
Color gris metálico o brillo plateado* Maleables (pueden laminarse para formar placas o laminas) Dúctiles (se pueden formar alambres con ellos) Forman compuestos iónicos con los no metales
Son resistentes y duros.
Tienen altos puntos de fusión y de ebullición.
NO METALES A presión y temperatura ambiente son líquidos gases o sólidos blandos y quebradizos
METALOIDES Elemento simple con algunas propiedades físicas y químicas de metales y no metales Mala conductividad eléctrica E Semiconductores de la (excepto el carbono en forma electricidad
de grafito) Malos conductores del calor Buenos aislantes térmicos (excepto el carbono en forma de diamante) Sin brillo Casi todos tienen brillo metálico No son maleables
Algunos son maleables
No dúctiles
Algunos son dúctiles
Forman compuestos iónicos con los metales y compuestos moleculares con los no metales Son poco resistentes y se desgastan con facilidad. Quebradizos en estado sólido Tienen bajo punto de fusión y ebullición
Poseen elevadas densidades. Algunos metales tienen propiedades magnéticas: son atraídos por los imanes. Forman cationes (iones positivos) Al contacto con el oxígeno se oxidan formando óxidos metálicos o básicos. Los óxidos de los metales si se combinan con el agua generan hidróxidos (bases )
Tienen baja densidad. No son atraídos por los imanes.
12. Forman aniones (iones negativos) 13. Al contacto con el oxígeno forman óxidos no metálicos llamados anhídridos. 14. Los anhídridos en contacto con el agua forman ácidos (oxácidos).
CLASIFICACIÓN CUÁNTICA DE LOS ELEMENTOS EN BLOQUES Clase es el grupo en el cual se localizan los elementos en la tabla periódica, donde los elementos se agrupan en subniveles o bloques. En función del tipo de orbitales que se están llenando, la Tabla Periódica se divide en cuatro bloques fundamentales:
TIPO DE ELEMENTOS
CLASE (BLOQUES O SUBNIVELES)
Elementos Representativos
Orbitales “s” y “p”
Elementos de Transición
Orbitales “d”
Elementos de Transición Interna
Orbitales “f”
Ejemplos: 3Li
= 1s2 2s1 5B
= 1s22s22p1 21Sc
= 1s22s22p63s23p64s23d1
57La
= 1s22s22p63s23p64s23d104p65s24d105p66s24f1 57La
= [ Xe]6s24f...
Similar Free PDFs

Elementos DE LA Tabla Periodica
- 5 Pages

La tabla periodica
- 10 Pages

Grupo 18 tabla periodica
- 9 Pages

Preguntas DE Tabla Periodica
- 11 Pages

Tabla periodica simple
- 1 Pages

Grupo 16 tabla periodica
- 11 Pages

Informe 3 TABLA PERIODICA
- 35 Pages

Tabla Periodica Presentacion
- 2 Pages

Actividad 3. Tabla Periodica
- 17 Pages

Taller-tabla-periodica
- 9 Pages
Popular Institutions
- Tinajero National High School - Annex
- Politeknik Caltex Riau
- Yokohama City University
- SGT University
- University of Al-Qadisiyah
- Divine Word College of Vigan
- Techniek College Rotterdam
- Universidade de Santiago
- Universiti Teknologi MARA Cawangan Johor Kampus Pasir Gudang
- Poltekkes Kemenkes Yogyakarta
- Baguio City National High School
- Colegio san marcos
- preparatoria uno
- Centro de Bachillerato Tecnológico Industrial y de Servicios No. 107
- Dalian Maritime University
- Quang Trung Secondary School
- Colegio Tecnológico en Informática
- Corporación Regional de Educación Superior
- Grupo CEDVA
- Dar Al Uloom University
- Centro de Estudios Preuniversitarios de la Universidad Nacional de Ingeniería
- 上智大学
- Aakash International School, Nuna Majara
- San Felipe Neri Catholic School
- Kang Chiao International School - New Taipei City
- Misamis Occidental National High School
- Institución Educativa Escuela Normal Juan Ladrilleros
- Kolehiyo ng Pantukan
- Batanes State College
- Instituto Continental
- Sekolah Menengah Kejuruan Kesehatan Kaltara (Tarakan)
- Colegio de La Inmaculada Concepcion - Cebu