Die Grignard Reaktion PDF

| Title | Die Grignard Reaktion |
|---|---|
| Course | Chemie für Biologen |
| Institution | Johannes Gutenberg-Universität Mainz |
| Pages | 10 |
| File Size | 490.6 KB |
| File Type | |
| Total Downloads | 53 |
| Total Views | 141 |
Summary
Download Die Grignard Reaktion PDF
Description
Die Grignard-Reaktion Die Grignard-Reaktion ist eine der klassischen metallorganischen Reaktionen zur Synthese von C-C-Bindungen. Im Allgemeinen versteht man unter einer Grignard-Reaktion die Umsetzung von Organomagnesiumhalogeniden R-Mg-X (den sogenannten Grignard-Verbindungen, mit X = Cl, Br, I und R = Alkyl, Aryl) mit Carbonyl-Verbindungen, die nach Hydrolyseder entstehenden Magnesium-Alkoholate entsprechende Alkohole liefert (Abb. 1) . Als Lösungsmittel werden in der Regel Ether verwendet, insbesondere Diethylether und Tetrahydrofuran (THF). Die Reaktion und die eingesetzten Organomagnesium-Verbindungen sind nach ihrem Entdecker Victor Grignard (Nobelpreis für Chemie 1912) benannt.
Abb.1
Allgemeines Reaktionsschema für die Grignard-Reaktion mir Carbonyl-Verbindungen
Die C-Mg-Bindung in den Grignard-Reagenzien ist stark polarisiert. Der negativ polarisierte organische Rest R greift formal den positiv polarisierten Carbonyl-Kohlenstoff nucleophil an. Der negativ polarisierte Carbonyl-Sauerstoff koordiniert an das positiv polarisierte Magnesium. Es entsteht ein Magnesium-Alkoholat, welches durch hydrolytische Aufarbeitung in den entsprechenden Alkohol überführt wird (Abb. 2) .
Abb.2
Formaler Ablauf der Grignard-Reaktion
Mechanismus der Grignard-Reaktion Bei der Grignard-Reaktion treten je nach eingesetztem Grignard-Reagenz offenbar verschiedene Mechanismen auf. Neben vier- und sechsgliedrigen Übergangszuständen kommen auch Mechanismen mit Ein-Elekronen-Übertragungen (Single Electron Transfer, SET) zum Tragen (z.B. bei sterisch gehinderten Grignard-Reagenzien). Typischerweise scheint die Reaktion aber über einen sechsgliedrigen Übergangszustand abzulaufen. Hierbei sind zwei Moleküle der Grignard-Verbindung involviert, von denen aber nur eines aufgebraucht wird (Abb. 3) .
Abb.3
Mechanismus der Grignard-Reaktion über einen sechsgliedrigen Übergangszustand
Synthese von Grignard-Verbindungen Grignard-Verbindungen R-MgX lassen sich aus den jeweiligen organischen HalogenVerbindungen R-X (X = Cl, Br, I; R = Alkyl, Aryl) und elementarem Magnesium in wasserfreien Lösungsmitteln, in der Regel Ether wie Diethylether oder THF, synthetisieren (Abb. 1) . Die Reaktivität der Halogen-Verbindungen nimmt bei dieser Reaktion vom Iod über das Brom zum Chlor hin ab. Das Magnesium wird meist in Form von Spänen eingesetzt (größere Oberfläche für die Reaktion). Da Magnesium häufig passiviert ist, kann es sein, dass die Reaktion nur sehr langsam einsetzt. In diesem Fall kann z.B. durch Zugabe von einigen Körnchen elementarem Iod, durch vorsichtiges Erhitzen und/oder Verwendung von Ultraschall probiert werden, die Passivierung zu entfernen und die Reaktion zum Starten zu bringen. Die Reaktion der HalogenVerbindung mit dem Magnesium ist in der Regel exotherm, so dass häufig unter Kühlung gearbeitet werden muss. Abb.1
Allgemeines Reaktionsschema für die Synthese von Grignard-Verbindungen
Die Synthese von Grignard-Verbindungen verdeutlicht folgendes Experimentalvideo (Abb. 2) am Beispiel der Umsetzung von 2-Iodpropan mit Magnesium zu 2-Propylmagnesiumiodid (Abb. 3) : Abb.2
Experimentalvideo zur Synthese von 2-Propylmagnesiumiodid
Abb.3
Im Experimentalvideo durchgeführte Reaktion
Häufig werden die Grignard-Verbindungen in situ erzeugt und direkt weiter umgesetzt. Diverse gängige Grignard-Reagenzien sind allerdings auch kommerziell als Lösung in Ether erhältlich (z.B. EtMgBr oder PhMgBr), was auch den hohen Stellenwert der Grignard-Reaktion in der Organischen Synthesechemie unterstreicht.
Grignard-Verbindungen in Lösung In Lösung liegen Grignard-Verbindungen RMgX im Gleichgewicht mit den jeweiligen Diorganylmagnesium-VerbindungenR2Mg und den Magnesiumdihalogeniden MgX2 vor (Abb. 4) . Dieses Gleichgewicht wird nach seinem Entdecker Wilhelm Schlenk auch als SchlenkGleichgewicht bezeichnet. Die Gleichgewichtslage ist vom verwendeten Lösungsmittel abhängig.
Abb.4
Schlenk-Gleichgewicht von Grignard-Verbindungen in Lösung
Die Gleichgewichtslage und ihre Lösungsmittelabhängigkeit beruhen u.a. auf der Eigenschaft der Grignard-Verbindungen in Lösung zwei Ether-Moleküle koordinativ an sich zu binden (Abb. 5) oder (auch in Abhängigkeit der Konzentration) Dimere zu bilden (Abb. 6) . Dies lässt sich durch die elektronische Struktur der Grignard-Verbindungen erklären: Das Magnesium in RMgX ist nur von vier Elektronen umgeben. Durch z.B. Koordination von zwei Ether-Molekülen wird ein Elektronenoktetterreicht, was zur Stabilisierung beiträgt. In Diethylether und THF liegt das Schlenk-Gleichgewicht auf Seite der RMgX-Spezies, weshalb diese beiden Lösungsmittel zu den geeignetsten für die Synthese von Grignard-Verbindungen und zur Durchführung von Grignard-
Reaktionen gehören. In 1,4-Dioxan als Lösungsmittel hingegen fällt MgX2 aus, das Gleichgewicht wird zu R2Mg hin verschoben.
Abb.5
Koordination zweier Diethylether-Moleküle durch ein Grignard-Reagenz Abb.6
Dimer-Bildung bei Grignard-Verbindungen
Eigenschaften von Grignard-Verbindungen Bei der C-Mg-Bindung in R-MgX handelt es sich um eine kovalente Bindung, die allerdings stark polarisiert ist. Die Eigenschaften des organischen Restes R ähneln daher stark denen von Carbanionen, z.B. die Tendenz zu nucleophilen Angriffen oder die leichte Protonierbarkeit. Letztere Eigenschaft macht man sich bei der Verwendung von Grignard-Reagenzien als Basen in verschiedenen Reaktionen zu Nutze. Sie zeigt aber auch, dass man bei der Synthese der Reagenzien und ihrer Verwendung auf Abwesenheit von Wasser und anderen protischen Lösungsmitteln achten muss. Diese Eigenschaft kann aber auch zum Austausch von Halogenen gegen Wasserstoff über die Synthese der Grignard-Verbindung und anschließende Hydrolyse genutzt werden, z.B. zur Herstellung deuterierter Verbindungen durch Verwendung von D2O (Abb. 7) .
Abb.7
Hydrolyse und Deuterolyse von Grignard-Verbindungen.
Grignard-Reagenzien gehen außerdem Transmetallierungen ein, was z.B. bei der KumadaKreuzkupplung Anwendung findet.
Varianten der Grignard-Reaktion In die Grignard-Reaktion können neben Carbonyl-Verbindungen wie Aldehyden und Ketonen auch viele weitere Substrate mit polarisierten Bindungen als Reaktionspartner für das GrignardReagenz eingesetzt werden. Abhängig vom verwendeten Reaktionspartner können statt Alkoholen auch andere Produkte synthetisiert werden. Die folgende Tabelle gibt eine Überblick über einige gängige Substrate für die Grignard-Reaktion und die jeweiligen Reaktionsprodukte, die auf den folgenden Seiten näher erläutert werden. Tab.1
Substrate und Produkte der Grignard-Reaktion
Reaktionspartner für RMgX
Reaktionsprodukt
Formaldehyd
primärer Alkohol
Aldehyd
sekundärer Alkohol
Keton
tertiärer Alkohol
Ameisensäureester
sekundärer Alkohol
Carbonsäureester
tertiärer Alkohol
Kohlensäureester
tertiärer Alkohol
Orthoameisensäureester
Aldehyd
Nitril
Keton
Imin
Amin
Kohlendioxid
Carbonsäure
Oxiran
Alkohol
Grignard-Reaktionen mit Aldehyden und Ketonen
Die Umsetzung von Grignard-Reagenzien mit Aldehyden oder Ketonen gehört zu den klassischen Varianten der Grignard-Reaktion. Als Reaktionsprodukte erhält man Alkohole, deren Substitutionsgrad von der jeweils eingesetzten Carbonyl-Verbindung abhängt (Abb. 1) .
Abb.1
Allgemeines Reaktionsschema für die Grignard-Reaktion mit Aldehyden oder Ketonen
Grignard-Reaktion mit Formaldehyd Die Umsetzung von R-MgX mit Formaldehyd liefert primäre Alkohole (Abb. 2) .
Abb.2
Grignard-Reaktion mit Formaldehyd
Grignard-Reaktion mit Aldehyden Höhere Aldehyde als Formaldehyd liefern bei der Reaktion mit R-MgX sekundäre Alkohole (Abb. 3) . Wenn die Reste R des Grignard-Reagenzes und R' des Aldehydes unterschiedlich sind, ensteht bei der Reaktion ein neues Chiralitätszentrum.
Abb.3
Grignard-Reaktion mit Aldehyden
Grignard-Reaktion mit Ketonen Die Reaktion von Ketonen mit R-MgX führt zu tertiären Alkoholen (Abb. 4) . Wenn die Reste R, R' und R'' alle drei unterschiedlich sind, so erhält man ein neues Chiralitätszentrum.
Abb.4
Grignard-Reaktion mit Ketonen
Grignard-Reaktionen mit Estern Ester stellen eine weitere gut geeignete Substanzklasse für Grignard-Reaktionen dar. Bei der Umsetzung von Carbonsäureestern werden zwei Equivalente des Grignard-Reagenzes verbraucht und man erhält Alkohole als Reaktionsprodukte (Abb. 1) . Das nach dem Angriff des ersten R-MgX-Moleküls enstandene Alkoholat kann intramolekular einen Rest R''O− als Fluchtgruppe rauswerfen und es entsteht ein Keton. Da Ketone eine höhere Reaktivität in der Grignard-Reaktion aufweisen als Ester, erfolgt die Weiterreaktion mit einem zweiten Equivalent R-MgX und man erhält nach hydrolytischer Aufarbeitung den Alkohol. Die Reaktion kann nicht auf der Stufe der Ketone gestoppt werden. Wird nur ein Equivalent R-MgX eingesetzt, erhält man ein Produktgemisch.
Abb.1
Allgemeines Reaktionsschema für die Grignard-Reaktion mit Estern
Grignard-Reaktion mit Ameisensäureestern Die Umsetzung von zwei Equivalenten R-MgX mit Ameisensäureestern liefert sekundäre Alkohole (Abb. 2) .
Abb.2
Grignard-Reaktion mit Ameisensäureestern
Grignard-Reaktion mit Carbonsäureestern Die Ester höherer Carbonsäuren als Ameisensäure liefern nach Reaktion mit zwei Equivalenten Grignard-Reagenz R-MgXtertiäre Alkohole. (Abb. 3) .
Abb.3
Grignard-Reaktion mit Carbonsäureestern
Grignard-Reaktion mit Kohlensäureestern Kohlensäureester besitzen zwei R'O−-Fluchtgruppen und reagieren mit drei Equivalenten RMgX zu tertiären Alkoholen (Abb. 4) .
Abb.4
Grignard-Reaktion mit Kohlensäureestern
Grignard-Reaktion mit Orthoameisensäureestern Orthoameisensäureester stellen einen Spezialfall unter den Grignard-Reaktionen mit Estern dar. Bei der Umsetzung mitR-MgX wirkt das Magnesium des Grignard-Reagenzes als Lewis-Säure und abstrahiert eine R'O−-Gruppe des Orthoameisensäuresters. Das entstehende Carbeniumion reagiert mit dem nucleophilen Rest R des Grignard-Reagenzes und man erhält unter der Reaktionsbedingungen stabile Acetale, die nach Hydrolyse die entsprechenden Aldehyde liefern (Abb. 5) .
Abb.5
Grignard-Reaktion mit Orthoameisensäureestern
Grignard-Reaktionen mit anderen Substraten Neben Aldehyden, Ketonen und Estern gibt es noch weitere Substanzklassen, die sich in Grignard-Reaktionen umsetzen lassen. Einige gängige Beispiele werden im folgenden vorgestellt.
Grignard-Reaktion mit Nitrilen Carbonsäurenitrile reagieren bei Umsetzung mit R-MgX zu schwerlöslichen Magnesium-IminVerbindungen, die nach hydrolytischer Aufarbeitung die jeweiligen Ketone liefern (Abb. 1) .
Abb.1
Grignard-Reaktion mit Nitrilen
Grignard-Reaktion mit Iminen Imine reagieren in der Grignard-Reaktion analog zu Aldehyden und Ketonen und führen entsprechend zu Aminen als Reaktionsprodukten (Abb. 2) . Sind die Reste R, R' und R'' unterschiedlich, entsteht ein neues Chiralitätszentrum.
Abb.2
Grignard-Reaktion mit Iminen
Grignard-Reaktion mit Kohlendioxid Kohlendioxid reagiert mit einem Equivalent R-MgX zum entsprechenden Magnesiumcarboxylat. Dieses reagiert nicht mit dem Grignard-Reagenz weiter und liefert nach Aufarbeitung die jeweilige Carbonsäure als Produkt (Abb. 3) .
Abb.3
Grignard-Reaktion mit Kohlendioxid
Grignard-Reaktion mit Oxiranen Oxirane (Epoxide, Oxacyclopropane) reagieren mit Grignard-Reagenzien unter Ringöffnung nach Hydrolyse zu Alkoholen. Bei unsymmetrisch substituierten Oxiranen kann der Angriff prinzipiell an beiden C-Atomen des Ringes erfolgen und man erhält ein Produktgemisch (Abb. 4) .
Abb.4
Grignard-Reaktion mit Oxiranen
Nebenreaktionen der Grignard-Reaktion Aufgrund der hohen Reaktivität der Grignard-Verbindungen kann es zu verschiedenen Nebenbzw. Konkurrenzreaktionen zur Grignard-Reaktion kommen. Aufgrund der starken Polarisisierung der C-Mg-Bindung können Grignard-Reagenzien auch als Basen eingesetzt werden. Bei Grignard-Reaktionen mit Carbonyl-Verbindungen, die α-ständige H-Atome aufweisen, kann es deshalb statt zur C-C-Verknüpfung auch zur Deprotonierung und Enolat-Bildung kommen (Abb. 1) . Die Hydrolyse des Magnesium-Enolats liefert schließlich die eingesetzte Carbonyl-Verbindung zurück.
Abb.1
Enolat-Bildung
Grignard-Reduktion Bei Verwendung sterisch gehinderter Carbonyl-Verbindungen und/oder sterisch gehinderter Grignard-Reagenzien mit β-ständigen H-Atomen kann als Konkurrenzreaktion zur C-CVerknüpfung eine Reduktion ablaufen. Hierbei wird über einen sechsgliedrigen Übergangszustand ein H-Atom der Grignard-Verbindung auf das C-Atom der Carbonyl-Gruppe übertragen. Das so erhaltene Magnesium-Alkoholat liefert nach Hydrolyse die entsprechenden Alkohole als Reduktionsprodukt (Abb. 2) . Diese Nebenreaktion zur Grignard-Reaktion wird als Grignard-Reduktion bezeichnet.
Abb.2
Grignard-Reduktion bei sterischer Hinderung...
Similar Free PDFs

Die Grignard Reaktion
- 10 Pages

EXP 4: Grignard
- 2 Pages

Grignard Reaction
- 5 Pages
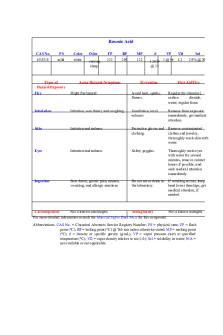
Grignard MSDS Report - sfdsdf
- 6 Pages

Grignard Reaction - SEE TITLE
- 13 Pages

Grignard Reaction Lab Report
- 11 Pages

Grignard experiment lab report
- 5 Pages

Reactivo de Grignard
- 7 Pages

Handout Grignard reaction
- 5 Pages

Die Standortwahl
- 3 Pages

Die Räuber
- 109 Pages

DIE PRÜFUNG
- 58 Pages
Popular Institutions
- Tinajero National High School - Annex
- Politeknik Caltex Riau
- Yokohama City University
- SGT University
- University of Al-Qadisiyah
- Divine Word College of Vigan
- Techniek College Rotterdam
- Universidade de Santiago
- Universiti Teknologi MARA Cawangan Johor Kampus Pasir Gudang
- Poltekkes Kemenkes Yogyakarta
- Baguio City National High School
- Colegio san marcos
- preparatoria uno
- Centro de Bachillerato Tecnológico Industrial y de Servicios No. 107
- Dalian Maritime University
- Quang Trung Secondary School
- Colegio Tecnológico en Informática
- Corporación Regional de Educación Superior
- Grupo CEDVA
- Dar Al Uloom University
- Centro de Estudios Preuniversitarios de la Universidad Nacional de Ingeniería
- 上智大学
- Aakash International School, Nuna Majara
- San Felipe Neri Catholic School
- Kang Chiao International School - New Taipei City
- Misamis Occidental National High School
- Institución Educativa Escuela Normal Juan Ladrilleros
- Kolehiyo ng Pantukan
- Batanes State College
- Instituto Continental
- Sekolah Menengah Kejuruan Kesehatan Kaltara (Tarakan)
- Colegio de La Inmaculada Concepcion - Cebu



