aislamiento de estreprococus PDF

| Title | aislamiento de estreprococus |
|---|---|
| Course | Biología |
| Institution | Universidad del Norte Mexico |
| Pages | 13 |
| File Size | 660.1 KB |
| File Type | |
| Total Downloads | 74 |
| Total Views | 277 |
Summary
Diagrama de flujo práctica # MEDIOS DE CULTIVO- Agar sangre.❖ Objetivo. Observar la capacidad hemolíticade los microorganismos patógenos (el cuales un factor de virulencia). Para ello sedistinguen halos hemolíticos alrededor delas colonias.❖ Uso. Permite el crecimiento de todos losMO presente. Si se...
Description
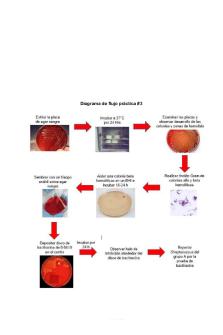
Diagrama de flujo práctica #3
MEDIOS DE CULTIVO
-
Agar sangre.
❖ Objetivo. Observar la capacidad hemolítica de los microorganismos patógenos (el cual es un factor de virulencia). Para ello se distinguen halos hemolíticos alrededor de las colonias. ❖ Uso.Permite el crecimiento de todos los MO presente. Si se añade sangre puede determinar diferentes tipos de hemólisis. Si se caliente se obtiene el agar chocolate. ❖ Composición.
➔ Infusión de músculo de corazón ------------- 375 g/L ➔ Peptona -------------------------------------------- 10 g/L ➔ Cloruro de sodio --------------------------------- 5 g/L ➔ Agar ------------------------------------------------- 15 g/L ➔ pH = 7.3 +- .2 ❖ Preparación I. Suspender 40 g del polvo en 1 litro de agua purificada. II. Dejar reposar 5 minutos y mezclar perfectamente hasta obtener una suspensión homogénea III. Calentar con agitación frecuente y hervir 1 minuto para disolución total IV. Esterilizar a 121°C durante 20 minutos. V. Agregar 5-10% de sangre ovina desfibrinada estéril (Britasheep)al medio esterilizado, fundido y enfriado a 45-50 °C. VI. Homogeneizar y distribuir en placas de Petri estériles. ❖ Interpretación.
-
-
-
Hemólisis alfa. Lisis parcial de los glóbulos rojos. Se observa un halo de color verdoso alrededor de la colonia en estudio. Es debido a la oxidación de la hemoglobina a metahemoglobina (compuesto de color verdoso) por el peroxido de hidrogeno generado por los MO. Hemólisis beta. Lisis total de glóbulos rojos. Se observa un halo claro, brillante alrededor de la colonia en estudio. Hemólisis gamma. Ausencia de lisis de los glóbulos rojos. El medio de cultivo no presenta modificaciones de color y aspecto alrededor de la colonia en estudio.
Agar BHI
❖ Objetivo. Medio sólido apropiado para el cultivo de bacterias y hongos, incluyendo los de difícil desarrollo. ❖ Uso. Útil como cultivo primario y para sembrar cepas puras de MO poco o medianamente exigentes para su posterior identificación.
❖ Composición. ➔ Infusión de cerebro de ternera --------------------- 200 g/L ➔ Infusión de corazón ----------------------------------- 250 g/L ➔ Peptona -------------------------------------------------- 10 g/L ➔ Cloruro de sodio --------------------------------------- 5 g/L ➔ Glucosa -------------------------------------------------- 2 g/L ➔ Fosfato disódico --------------------------------------- 2.5 g/L ➔ Agar ------------------------------------------------------- 15 g/L ➔ pH = 7.4 +- 0.2 ❖ Preparación.
I. II. III.
Disolver 52 g de polvo en 1 litro de agua purificada. Calentar con agitación frecuente y llevar a ebullición hasta su disolución total. Distribuir en recipientes apropiados y esterilizar en autoclave durante 15 minutos a 121 °C.
IV.
Distribuir en placas petri estériles. En caso de preparar agar sangre Agregar 5-10 % de sangre ovina desfibrinada estéril al medio esterilizado, fundido y enfriado a 45-50. Homogeneizar y distribuir en placas Petri estériles. ❖ Interpretación. - Streptococcus pyogenes. Crecimiento satisfactorio
PRUEBAS BIOQUÍMICAS. -
Prueba de Bacitracina
➢ Objetivo. Diferenciación de estreptococos beta hemolíticos del grupo A de otros estreptococos beta hemolíticos. ➢ Fundamento. La bacitracina inhibe la síntesis de pared celular bacteriana, y a la concentración que se encuentra en los discos (0.04 U) inhibe el crecimiento de los estreptococos beta hemolíticos del grupo A de Lancefield pero no inhibe el desarrollo de otros estreptococos beta hemolíticos. ➢ Técnica. I. Realizar una suspensión del microorganismo en estudio. II. Mediante la técnica de hisopado en superficie, inocular el microorganismo en estudio en una placa de Agar Sangre. III. Colocar un disco de Bacitracina de 0,04 U sobre la superficie del agar. Interpretación. IV. Observar si existe zona de inhibición del desarrollo microbiano alrededor del disco de Bacitracina 0.04 U.
➢ Precauciones.
A. Algunos estreptococos que no son del grupo A también pueden ser inhibidos por bacitracina, por lo tanto con frecuencia se realiza con la prueba de sensibilidad al SXT. B. Es bastante exacta como una prueba presuntiva pero no es altamente específica. Más del 10% de los estreptococos de los grupos C y G y 5% de las cepas del grupo B también son sensibles a la bacitracina. C. Sólo deben ser investigados estreptococos beta hemolíticos ya que muchos estreptococos beta hemolíticos (incluso S. pneumoniae) son sensibles a concentraciones bajas de bacitracina. D. El crecimiento del inóculo bacteriano debe ser confluente; un inóculo demasiado escaso producirá que los estreptococos que no son del grupo A parezcan sensibles a la bacitracina. E. No utilizar positivo (+) y negativo (-) para indicar los resultados; utilizar la denominación S (sensible, susceptible) y R (resistente). Los términos positivo y negativo podrían denotar crecimiento o ausencia de crecimiento en la placa pero no necesariamente alrededor del disco.
-
Prueba CAMP
➢ Objetivo. Separar Streptococcus agalactiae de los demás estreptococos ß-hemolíticos. ➢ Fundamento. Se basa en que los estreptococos del grupo B producen un factor llamado CAMP (factor de monofosfato de adenina cíclica) que aumenta la zona de hemólisis producida por un estafilococo productor de ß-lisina. ➢ Interpretación. La prueba positiva se evidencia por la presencia de una zona de potenciación de la hemólisis en forma de puntas de flecha en el lugar donde se contactan las dos estrías. ➢ Técnica. I. Se realiza estriando de un cultivo de estreptococo ß-hemolítico en forma perpendicular a una estría de un staphylococcus aureus productor de ß-lisina en agar sangre. II. Se incuba 18-24 horas a 37ºC. ➢ Precauciones. CAMP estándar con S. aureus subsp. aureus A. Antes de ser probados para la reacción CAMP, los MO beta hemolíticos deben ser identificados como miembros del género Streptococcus mediante una prueba de catalasa y una tinción de Gram. B. Esta prueba CAMP se utiliza para ayudar en la identificación estreptococos del grupo B. No debe confiarse en una única prueba para la identificación
C.
D. E.
F.
-
presuntiva de los MO humanos o bovinos del grupo B; una reacción CAMP positiva debe utilizarse en combinación con otras pruebas y criterios. La superficie del agar debe estar completamente seca, cualquier condensación facilitará la diseminación, el escurrimiento y la mezcla del inóculo. Debe utilizarse sangre citratada o desfibrinada de oveja o de buey (no se producirá reacción con sangre de caballo, humano, conejo o cobayo). La profundidad del agar sangre en el centro debe ser cerca de 1.5 mm. A medida que aumenta la profundidad, las puntas de flecha de la hemólisis se tornan menos separadas. Después de la inoculación es necesario evitar la inclinación de las placas hasta que el inóculo se haya absorbido en el agar, por que los inóculos pueden desparramarse en la placa, dando resultados mixtos e inválidos. Prueba PYR.
➢ Objetivo. Separar Streptococcus pyogenes y Enterococcus de los demás estreptococos. ➢ Fundamento. Permite la identificación presuntiva de ciertas bacterias en base a la actividad enzimática I-pirrolidonil arilamidasa (PYRasa). Los MO que contienen esta enzima hidrolizan en forma rapida el sustrado presente en los discos y liberan un grupo pirrolico que reacciona con el reactivo cinamaldehido originandose un compuesto de color rosado-rojizo. ➢ Interpretación. ● Positivo: presencia de actividad enzimática pirrolidonil arilamidasa: disco color rosado a rojo. ● Negativo: Ausencia de actividad enzimática pirrolidonil arilamidasa; disco y/o solución color amarilla o incoloro. ➢ Técnica. I. Medio: Agar con tripticasa y soja (TSA) con sustrato al 0.01%. II. Inóculo: Con un asa de inoculación estéril, tomar 2-3 colonias con morfología similar y emulsionar en el caldo. III. Incubar a 35°C, 4 h IV. Estriar para aislamiento. V. Agregar 1 gota del reactivo PYR/LAP directamente a la superficie de crecimiento de la placa. VI. Observar el cambio de color despues de 2 min. ➢ Precauciones A. Antes de llevar a cabo la prueba PYR, confirmar que el MO es un coco gram positivo beta hemolítico y que es catalasa negativo. B. Los aislamientos clínicos de posibles estreptococos son comprobados preferentemente antes de las 48 h de incubación o subcultivos antes de la comprobación. Los aislamientos PYR negativos después de más de 48 h deben ser resueltos por el empleo de aislamientos frescos o por métodos convencionales.
C. Probar cada nuevo lote de reactivo PYR todos los días que se lleva a cabo la prueba. D. Pueden ser necesarias pruebas bioquímicas y serológicas adicionales para la identificación definitiva.
-
Hidrólisis de hipurato
➢ Objetivo. Detectar la hidrólisis de hipurato sódico por los estreptococos betahemolíticos grupo B y otros organismos. ➢ Fundamento. El hipurato sódico, cuando es hidrolizado por la enzima bacteriana hipuricasa, da lugar a ácido benzoico y glicina. La prueba rápida de hipurato utiliza ninhidrina para detectar la presencia de glicina. La ninhidrina y la glicina producen una reacción por la cual se elimina el grupo amino y se origina agua y amoniaco. El amoniaco atraviesa una secuencia de pasos para producir un color morado. ➢ Interpretación. ➔ Una reacción de hipurato positiva se indica por el cambio del color de la solución a azul morado. ➔ Una reacción de hipurato negativa se indica por la ausencia de un cambio del color de la solución. ➢ Procedimiento de Hwang y Ederer. I. Dispensar 0.4 mL de agua destilada o desionizada estéril en un tubo pequeño (15 x 125 mm) y añadir un disco de hipurato y ajustar herméticamente las tapas o los tapones. II. Realizar un inóculo abundante; una asa grande de cultivo puro de especies Streptococcus beta hemolítico III. Emulsificar completamente una muestra grande obtenida con asa del organismo a analizar en el agua y agite el tubo a mano o en agitador vórtex para formar una suspensión uniforme. IV. Incubar el tubo en un baño de María o estufa a 35 – 37 °C durante 2 h. V. Después de la incubación, añadir 0.2 mL (5 gotas) de reactivo de ninhidrina al tubo (añadir lentamente) y agite suavemente. VI. Vuelva a incubar el tubo durante 10 – 15 min y lea la reacción. VII. Registrar los resultados. ➢ Precauciones. A. Si se usan reactivos de FeCl3 o ninhidrina, deben correrse controles positivos y negativos junto con los MO de la prueba; si el medio sin sembrar se usa como
control negativo, el tubo debe inocularse junto con los MO de la prueba para simular el mismo ambiente. B. La hidrólisis del hipurato se usa para la identificación dentro del género Streptococcus; sin embargo, esta capacidad enzimática también se encuentra en algunas especies de otros géneros;
C. No debe aplicarse indiscriminadamente a todos los grupos de estreptococos; solo es útil para los beta hemolíticos de origen humano o bovino. D. La solución de hipurato se deteriora en 7 días a 4°C y debe permanecer congelada cuando no está en uso. E. El precipitado coloreada puede ser destruido por el agregado de ácidos o bases. REFERENCIAS -
LABORCLIN. 10097010-137 AGAR SANGRE. 540195-BIPLACA-SANGRE-AGARTSA-2X10mL-10PL.pdf (laborclin.com.br) BRITANIA. B0214705. upl_5a281eacb5ee1.pdf (britanialab.com) Marielsa Gil. (2019). Agar BHI: fundamento, preparación y usos. 20/02/2021, de Lifeder Sitio web: https://www.lifeder.com/agar-bhi/ Jean F. MacFaddin. (2000). Pruebas Bioquímicas para la identificación de Bacterias de Importancias Clínica. Bogotá, Argentina: Panamericana .
Diagrama de flujo práctica #4 1. Utilice una colonia alfa hemolítica aislada en una placa de agar sangre o un c e B
2. Inocule una placa de agar de bilis esculina (BEM). E incube por 24 horas a 37
3. Tome el centro de una colonia esculina positiva e inocule un tubo de BHI que contenga un 7.5% de NaCl e incube a 37°C por 24 h
Medios de cultivo ❏ Agar BHI salado (6.5%) - Objetivo Medio de cultivo para distinción e identificación de enterococos y estreptococos. - Uso El caldo BHI es un medio de cultivo nutritivo tamponado que contiene infusiones de tejido de cerebro y corazón y peptonas para suministrar proteínas y otros nutrientes necesarios para favorecer el crecimiento de microorganismos exigentes y no exigentes. En la fórmula con cloruro de sodio al 6,5%, la sal actúa como agente de diferenciación o selección, al interferir con la permeabilidad de la membrana y los equilibrios osmótico y electrocinético en los organismos no tolerantes a la sal. - Composición Infusión de cerebro y corazón (sólidos) …… 6,0 g Digerido péptico de tejido animal …… …….. 6,0g Cloruro sódico ………………………………… 5,0 g Dextrosa……………………………………….. 3,0 g Digerido pancreático de gelatina …………….14,5 g Fosfato disódico ………………………………. 2,5 g - Preparación Suspender 97 gramos en 1000 mL de agua purificada suspenda en tubos y esterilice en autoclave a 15 lbs de presión a 121°C por 15 minutos. Interpretación La turbiedad del medio indica crecimiento de microorganismos. Si es un coco gram positivo, catalasa negativa se trata de Enterococcus spp. No habiendo crecimiento de microorganismos, medio sin alteración de turbiedad se trata de Streptococcus spp. Otras pruebas podrán completar la identificación cuando sean necesarias
.
❏ BEM - Objetivo Medio selectivo y diferencial para aislar e identificar un gran número de miembros del género Enterococcus, y también Streptococcus del grupo D - Uso Medio utilizado para el aislamiento e identificación presuntiva de estreptococos del grupo D. - Composición Extracto de carne …………… 3,0 g Peptona de carne …………… 5,0 g Bilis de buey ………………… 40,0 g Esculina ……………………… 1,0 g Citrato férrico ………………… 0,5 g Agar …………………………… 15,0 g - Preparación Suspender 64,5 g del polvo en 1 litro de agua purificada. Dejar reposar 5 minutos. Calentar a ebullición hasta su completa disolución. Distribuir en tubos u otros recipientes apropiados y esterilizar en autoclave a 121°C durante 15 minutos. - Interpretación Positivo: se observa un oscurecimiento o ennegrecimiento del medio de cultivo. Negativo: ausencia de oscurecimiento del medio de cultivo.
❏ SF - Objetivo El SF es un medio selectivo para la detección de estreptococos fecales. - Uso El medio SF se utiliza para la diferenciación de la especie enterococcus del grupo Streptococcus bovis y otros estreptococos. - Composición Digerido pancreático de caseína ………… 20,0 g Dextrosa ……………………………………. 5,0 g Fosfato dipotásico …………………………. 4,0 g Fosfato monopotásico ……………………. 1,5 g Azida sódica ………………………………. 0,5 g Cloruro sódico ……………………………… 5,0 g Púrpura de bromocresol ……………………. 0,032 g - Preparación Suspender 36 gramos de caldo SF en 1000 mL de agua destilada. Hierba para disolver el medio completamente, y dispense en tubos y esterilice en la autoclave a 15 lbs de presión a 121°C por 15 minutos. - Interpretación Una reacción positiva se indica mediante turbidez y un color amarillo-marrón debido a la fermentación de dextrosa y el cambio de color resultante del indicador púrpura de bromocresol. Una reacción negativa se indica mediante la ausencia de cambio de color morado del medio.
❏ KF - Objetivo El Agar Estreptocócico KF es un medio selectivo para el aislamiento y la enumeración de enterococos fecales en agua, alimentos y otros materiales, según la fórmula desarrollada por Kenner, Clark y Kabler. - Uso
Este medio se utiliza para el recuento en placa de enterococos en muestras de agua y para determinar la presencia de Enterococcus faecalis en la leche y sus derivados, así como en otros alimentos. La mezcla de peptona proporciona nitrógeno, vitaminas, minerales y aminoácidos esenciales para el crecimiento. El extracto de levadura es una fuente de vitaminas, particularmente del grupo B. La maltosa y la lactosa son carbohidratos fermentables que proporcionan carbono y energía. El glicerofosfato de sodio es un agente tamponador. La azida sódica es un agente selectivo que inhibe las bacterias Gram negativas. El cloruro de sodio suministra electrolitos esenciales para el transporte y el equilibrio osmótico. El agar bacteriológico es el agente solidificante. - Composición Agar bacteriológico……………..… 20 g Maltosa…………………………..… 20 g Azida de sodio ………………….... 0,4 g Glicerofosfato sódico ………….... 10,0 g Lactosa …………………………... 1,0 g Mezcla de peptona …………….. 10,0 g Cloruro sódico ………………..….. 5,0 g Extracto de levadura ……………. 10,0 g - Preparación Suspender 76,4 gramos del medio en un litro de agua destilada. Mezclar bien y disolver por calentamiento agitando con frecuencia. Hervir durante un minuto hasta su completa disolución. Evitar el exceso de calor. NO AUTOCLAVAR. Enfriar a 45-50 ºC y agregar asépticamente dos viales de Suplemento de TTC al 1% (Cat. 6030), previamente reconstituidos (cada uno) en 5 ml de agua destilada estéril. Homogeneizar suavemente y dispensar en placas de Petri. -
Interpretación Las colonias rojas o rosadas se cuentan como enterococos fecales, mientras que las colonias naranjas, amarillas, blancas o de otros colores no se cuentan. El número de enterococos fecales se calcula por 100 ml de agua.
Referencias: “Caldo BHI 6.5%” Recuperado de: https://es.renylab.ind.br/wpcontent/uploads/2018/05/Caldo-BHI-NaCL-65.pdf consultado el 20 de febrero de 2021.
“Bilis esculina agar” Recuperado de: https://www.britanialab.com/back/public/upload/productos/upl_5a281ad50f34a.pdf consultado el 20 de febrero de 2021. “Agar estreptocócico KF” CONDALAB. Consultado el 20 de febrero de 2021. https://www.sigmaaldrich.com/content/dam/sigma“SF Broth” Recuperado de: aldrich/docs/Sigma/Datasheet/5/s6306dat.pdf consultado el 20 de febrero de 2021....
Similar Free PDFs
aislamiento de estreprococus
- 13 Pages

1. Aislamiento DE Tuberias
- 18 Pages

PRUEBA DE RESISTENCIA DE AISLAMIENTO
- 56 Pages

Sistemas de aislamiento doble
- 12 Pages

Aislamiento absoluto
- 3 Pages
Práctica 15 Aislamiento de DNA
- 7 Pages

Nivel Aislamiento
- 1 Pages

Tema 1. AISLAMIENTO
- 7 Pages

Taller 1 aislamiento
- 4 Pages
Popular Institutions
- Tinajero National High School - Annex
- Politeknik Caltex Riau
- Yokohama City University
- SGT University
- University of Al-Qadisiyah
- Divine Word College of Vigan
- Techniek College Rotterdam
- Universidade de Santiago
- Universiti Teknologi MARA Cawangan Johor Kampus Pasir Gudang
- Poltekkes Kemenkes Yogyakarta
- Baguio City National High School
- Colegio san marcos
- preparatoria uno
- Centro de Bachillerato Tecnológico Industrial y de Servicios No. 107
- Dalian Maritime University
- Quang Trung Secondary School
- Colegio Tecnológico en Informática
- Corporación Regional de Educación Superior
- Grupo CEDVA
- Dar Al Uloom University
- Centro de Estudios Preuniversitarios de la Universidad Nacional de Ingeniería
- 上智大学
- Aakash International School, Nuna Majara
- San Felipe Neri Catholic School
- Kang Chiao International School - New Taipei City
- Misamis Occidental National High School
- Institución Educativa Escuela Normal Juan Ladrilleros
- Kolehiyo ng Pantukan
- Batanes State College
- Instituto Continental
- Sekolah Menengah Kejuruan Kesehatan Kaltara (Tarakan)
- Colegio de La Inmaculada Concepcion - Cebu






