Degrabada de parasitologia final PDF

| Title | Degrabada de parasitologia final |
|---|---|
| Author | Luis Enrique Torres Zuasnabar |
| Course | PARASITOLOGÍA |
| Institution | Universidad de San Martín de Porres |
| Pages | 91 |
| File Size | 3.9 MB |
| File Type | |
| Total Downloads | 854 |
| Total Views | 966 |
Summary
NAEGLERIA FOWLERILa Naegleria es una ameba que pertenece a los protozoos que se denominan de «vida libre» puesto que son capaces de sobrevivir y replicarse en el medio&n...
Description
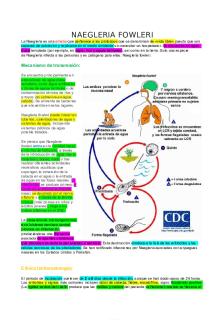
NAEGLERIA FOWLERI La Naegleria es una ameba que pertenece a los protozoos que se denominan de «vida libre» puesto que son capaces de sobrevivir y replicarse en el medio ambiente sin necesitar un hospedador. Se encuentra en agua dulce templada (por ejemplo, en lagos, ríos y aguas termales), así como en la tierra. Solo una especie de Naegleria infecta a las personas y es patógena para ellas: Naegleria fowleri.
Mecanismo de transmisión: Se encuentra principalmente en extensiones de agua dulce templada, como lagos artificiales y zonas de aguas termales o de contaminación térmica de ríos y arroyos (no sobrevive en agua salada). Se alimenta de bacterias que encuentra en estos lugares. Naegleria fowleri puede crecer en tuberías, calentadores de agua y sistemas de agua, incluyendo sistemas públicos de agua potable tratados. Se piensa que Naegleria fowleri entra en la cavidad nasal, en forma de trofozoito, a través de la introducción de agua tras la inmersión, buceo, nado o tras realizar diferentes actividades recreativas acuáticas que supongan la inmersión de la cabeza en el agua o la entrada de agua en las fosas nasales. La infectividad se produce primero a través de la unión a la mucosa nasal, se desplaza por el nervio olfatorio y a través de la lámina cribosa (más porosa en niños y adultos jóvenes), llega a los bulbos olfativos en el SNC. La presencia de microorganismos en el sistema nervioso central provoca un inflamación, produciéndose una liberación asociada de agentes citotóxicos que provocan un daño tisular extenso y necrosis. Esta destrucción conduce a la lisis de los eritrocitos y las células nerviosas de los alrededores. Se han notificado infecciones por Naegleria asociadas con enjuagues nasales en los Estados Unidos y Pakistán.
Clínica (sintomatología): El periodo de incubación suele ser de 2 a 8 días desde la infección, aunque se han dado casos de 24 horas. Los síntomas y signos más comunes incluyen dolor de cabeza, fiebre, escalofríos, signo Brudzinski positivo (La rigidez severa del cuello produce que las rodillas y cadera del paciente se flexionen cuando se flexiona el
cuello), signo Kernig positivo (El examinador coloca una mano debajo de la espalda del sujeto y trata de hacerlo sentar pasivamente mientras que el brazo libre del examinador ejerce oposición sobre las rodillas, el paciente involuntariamente flexiona las piernas, inevitablemente acercando las rodillas hacia el tórax a pesar de la oposición del examinador, también se obtiene cuando el paciente tiene sus rodillas flexionadas al máximo (a nivel del pecho a 90 grados) y el examinador intenta extender una de las extremidades por el talón. El ejercicio resulta tan doloroso para el sujeto que se resiste de tal manera que mantiene las rodillas flexionadas), fotofobia(tolerancia anormal a la luz por la molestia o dolor que produce), confusión, convulsiones, coma, que dan nombre al cuadro conocido como meningoencefalitis amebiana primaria (MAP) Además, las anomalías del ritmo cardíaco y la necrosis miocárdica se han observado en algunos casos. El aumento de la presión intracraneal y la presión de líquido cefalorraquídeo (LCR) se han asociado directamente con la muerte que suele sobrevenir en más de un 95% de los casos y suele suceder a los 7-10 días.
Diagnóstico: – El examen del líquido cefalorraquídeo (LCR) demuestra turbidez y puede ser levemente hemorrágico, destaca una pleocitosis( Aumento del número de células en un fluido corporal) con predominio de células polimorfonucleares. – El diagnóstico definitivo se realiza con la identificación del microorganismo en biopsias cerebrales o cutáneas o mediante cultivo. El trofozoito móvil se puede visualizar en una preparación en fresco o tras tinción de Wright o Giemsa del LCR o en muestras histológicas obtenidas de la biospia. – La PCR en tiempo real es también útil para el diagnóstico, pero no está disponible en todas las instituciones, encontrándose exclusivamente en los laboratorios de referencia. – Las pruebas serológicas no son de utilidad porque los pacientes suelen fallecer antes de desarrollar una respues inmune detectable.
Tratamiento: Un factor clave para un tratamiento eficaz es la rapidez del diagnóstico. Aunque hasta el momento, no existe un único tratamiento curativo apropiado. – Anfotericina B: la concentración minima inhibitoria de este fármaco que se necesita para matar al 100% de los organismos en los estudios in vitro es del 0,78 g/ml, ya sea por vía intravenosa o por vía intratecal, – Azitromicina: este antibiótico macrólido, se ha probado in vitro contra N. fowleri y ha demostrado suprimir más del 90% del crecimiento del organismo a concentraciones de 10 y 100 g / ml.
Prevención: El agua clorada como el agua salada disminuye significativamente el riesgo de infección por N. Fowleri debido a la incapacidad de esta para sobrevivir en tales ambientes. La principal medida es evitar la exposición a todos aquellos que vayan a realizar actividades en aguas dulces, las medidas recomendadas son evitar salpicar o sumergir la cabeza bajo el agua para evitar la posibilidad de contacto de esta ameba con las fosas nasales. Otra posibilidad es utilizar pinzas nasales para disminuir esta posibilidad.
Acanthamoeba spp Acanthamoeba fue descrita en 1930, cuando reportó la presencia de una ameba en un cultivo de Cryptococcus pararoseus. Era una ameba que presentaba numerosas proyecciones espinosas y superficiales, conocidas como acantopodios. Desde que se conoció que diferentes amebas de vida libre pueden afectar el sistema nervioso central (SNC), el término encefalitis amebiana granulomatosa (EAG) ha sido usado para referirse a infecciones del SNC causadas por Acanthamoeba spp. La Acanthamoeba se conoce como un microorganismo anfizoico debido a que tienen la capacidad de existir como amebas de vida libre y como parásitos patógenos y oportunistas.
Biología y distribución Las especies de Acanthamoeba están entre los protozoos más frecuentes encontrados en la naturaleza. Están distribuidas por todo el mundo y han sido aisladas de tierra, polvo, aire, agua dulce natural y tratada, agua de mar, piscinas, aguas residuales, sedimentos, aire acondicionado, hospitales, lentes de contacto y cultivos celulares. También han sido aisladas de la vegetación; de animales incluyendo especies de peces, anfibios, reptiles y mamíferos; de la cavidad nasofaríngea de personas aparentemente sanas y de pacientes inmunodeficientes. El ciclo de vida de las especies de Acanthamoeba involucra dos estadios: una forma activa o trofozoito y una forma latente conocida como quiste. El trofozoito varía en tamaño de 25 a 40 μιη y se alimenta por fagocitosis de bacterias, algas y levaduras mediante seudópodos; aunque también puede vivir en forma axénica por medio de la captación de nutrientes disueltos en el ambiente, a través de un proceso de pinocitosis. El quiste está compuesto de una doble pared, la exterior se conoce como ectocisto mientras que a la pared interna se le denomina endocisto. El tamaño del quiste puede variar de 13 a 20 μm de acuerdo a la especie. La formación del quiste ocurre bajo condiciones ambientales adversas como la falta de alimento, la desecación y los cambios en la temperatura y pH2.
Acanthamoeba spp como parásitos patógenos y oportunistas Las amebas del género Acanthamoeba tienen la capacidad de vivir como microorganismos de vida libre en la naturaleza y ocasionalmente invadir a un hospedero y vivir como parásitos dentro de él. Los tipos de infecciones más comunes producidas por Acanthamoeba spp. incluyen EAG, infecciones diseminadas (cutáneas y nasofaríngeas) y queratitis. La ruta de invasión al SNC en los casos de EAG es probablemente a través de las vías respiratorias inferiores. Dentro de los síntomas clínicos característicos de esta patología, están las alteraciones en el estado mental, cambios en el comportamiento, convulsiones, cefalea, afasia, fiebre, rigidez de cuello, alteración de la visión, anorexia, náuseas y vómitos, ataxia, coma y muerte. La EAG está generalmente asociada a enfermos crónicos por tumores malignos, lupus, diabetes mellitus, falla renal, cirrosis, tuberculosis, entre otros. Entre los factores que predisponen su incidencia se incluyen el alcoholismo, el abuso de drogas, el embarazo, el tratamiento con corticoesteroides, la quimioterapia, la radioterapia y el trasplante de órganos. Las especies del género Acanthamoeba también pueden infectar directamente la córnea causando queratitis. Esta infección es altamente resistente a terapias y frecuentemente resulta en una marcada deficiencia visual o incluso una pérdida total del ojo afectado. Cuando la infección es lo suficientemente grave, puede causar abrasión en la córnea ocasionando opacidad, iritis y a menudo escleritis. Los síntomas ocasionados incluyen enrojecimiento, epífora, dolor intenso, fotofobia y edema. El uso de lentes de contacto o un trauma en la córnea son los principales factores de riesgo asociados a esta infección15. En algunos pacientes se han encontrado lesiones en la piel que se caracterizan por la presencia de nódulos duros eritematosos y úlceras dolorosas en el tronco o extremidades. La acantamebiasis cutánea, a menudo es un reflejo de la enfermedad diseminada; es una infección cada vez más reconocida desde la aparición del síndrome de inmunodeficiencia adquirida (SIDA) y el uso de fármacos inmunosupresores, generalmente en pacientes receptores de trasplantes. La enfermedad augura un mal pronóstico y es fatal si la infección afecta al SNC. Además, se han encontrado trofozoitos y quistes en tejido pulmonar produciendo lesiones consistentes con neumonitis. Este tipo de infecciones, junto con la bronquiolitis, siguen siendo una importante causa de mortalidad durante los primeros años después de un trasplante de pulmón.
Patogenia de la infección por Acanthamoeba El primer paso crítico es su adhesión a la superficie de los tejidos a través de la expresión de una proteína transmembranal como proteína de unión a manosa MBP, que se une a glicoproteínas que contienen manosa expresadas en las células blanco. La MBP contiene en su porción extracelular repeticiones ricas en cisteína, las cuales también podrían inducir la unión de protozoos individuales y llevar a la formación de agregados. Además de esta adhesina, otra podría estar participando en la patogénesis de Acanthomoeba: la proteína de unión a laminina, uno de los principales constituyentes de la matriz extracelular23. Subsecuente a la adhesión, la ameba produce diferentes enzimas hidrolíticas como proteasas y fosfolipasas, que trabajan en conjunto para producir un potente efecto citopático que involucra el incremento en la concentración de Ca++, cambios
en la estructura del cito-esqueleto y en la morfología celular, aumento en la permeabilidad de la membrana celular y mitocondrial, degradación de la matriz extracelular y finalmente, la muerte de la célula. Se conoce también que este microorganismo expresa ecto-ATPasas en su membrana que hidrolizan el ATP en ADP, el que puede unirse a receptores celulares causando un incremento en la concentración de Ca++, lo que activa diferentes cascadas de señalización que llevan a la muerte de la célula por apoptosis24. Otro aspecto importante en la virulencia de Acanthomoeba parece ser la capacidad de fagocitar la célula blanco; un proceso que requiere la inducción de re-arreglos en el cito-esqueleto y la formación de amoebastomas en la superficie celular. Esto ha sido reportado en cultivos de células epiteliales de córnea con Acanthomoeba, donde se observa la formación de los amoebastomas después de cierto tiempo de incubación y gracias a la inhibición de la actividad fagocítica de la ameba cuando se utilizan inhibidores de la polimerización de actina como la citocalasina D25. Este parásito también ejerce su acción patogénica bloqueando genes importantes en el proceso de división celular, lo que induce la muerte de la célula y evita la regeneración tisular23. Metabolismo Los datos generados predicen que Acanthamoeba exhibe una gran capacidad biosintética de aminoácidos, co-factores y nucleótidos, moléculas orgánicas esenciales para su crecimiento. Los resultados sugieren también que Acanthamoeba puede incrementar la diversidad de sus fuentes de alimento, ya que tiene la capacidad de sintetizar enzimas como la alginatoliasa que le proporciona acceso a las bacterias a través de la matriz extracelular que compone la biopelícula(Las biopelículas son organizaciones microbianas compuestas por microorganismos que se adhieren a las superficies gracias a la secreción de un exopolímero. Estas conformaciones microbianas presentan características como heterogeneidad, diversidad de microambientes, resistencia a antimicrobianos y capacidad de comunicación intercelular que las convierten en complejos difíciles de erradicar de los ambientes donde se establecen); enzimas como la polihidroxibutirato despolimerasa que facilita la utilización del PHA presente en el interior de las bacterias como fuente de alimento; enzimas para la síntesis y degradación de la celulosa y la enzima sintasa trehalosa6-fosfato que juega un papel importante en la adaptación al estrés39.
Diagnóstico de la infección por Acanthamoeba El diagnóstico de una infección por Acanthamoeba ha incluido, hasta ahora, diversas técnicas donde el método de cultivo in vitro es todavía usado y en algunos casos el único disponible para confirmar la infección. Muestras de líquido cefalorraquídeo, tejido cerebral, material cutáneo o raspado de córnea pueden ser inoculados en medio de crecimiento para amebas. También es posible realizar un diagnóstico histológico a partir de biopsias de piel, cerebro o córnea, utilizando diferentes métodos de tinción. La tinción hematoxilina-eosina no es diferencial pero macrófagos y células del sistema inmune se distinguen de la ameba debido a diferencias en la morfología nuclear. La estructura nuclear de Acanthamoeba se caracteriza por un pronunciado cariosoma rodeado de un halo. Sin embargo, otros métodos de tinción han resultado ser muy útiles para la identificación de quistes en secciones de tejidos. La tinción es usado para identificar quistes en tejido cerebral. Estos métodos de tinción revelan generalmente las amebas localizadas en espacios perivasculares e invadiendo vasos sanguíneos. El uso de inmunofluorescencia empleando anticuerpos específicos contra especies de Acanthamoeba ha sido usado para detectar amebas en biopsias de tejidos. También se ha empleado la observación directa de la córnea a través de microscopia confocal para el diagnóstico de queratitis.
Balamuthia mandrillaris Las AVL son protistas inherentes habitantes del suelo, lodo y agua. Algunos de ellos son causa importante de enfermedades de baja frecuencia pero con una altísima mortalidad (mayor a 98%). Las AVL por lo general ingresan por la cavidad nasal y atacan al sistema nervioso central (neurotropismo), pero también pueden ingresar a través de la piel causando enfermedad en individuos: inmunocompetentes e inmunodeficientes. Las 4 especies causantes de lesiones neurológicas son Acanthamoeba genotipo T4 principalmente, B. mandrillaris y Sappinia pedata conocidas como encefalitis granulomatosa amebiana (EGA); e infecciones oportunistas como meningoencefalitis amebiana primaria por N. fowleri. La infección puede adquirirse por el contacto con aguas contaminadas o suelo, como en los casos por Acanthamoeba y/o Naegleria. La exposición a suelo o arena puede ser un factor de riesgo y el nadar en estanques y lagos parece ser un antecedente común.
Ciclo biológico de Acanthamoeba y Balamuthia Acanthamoeba tiene dos estadios de su ciclo de vida, una de alimentación y reproducción en fase de trofozoíto y un estado de quiste resistente. Los trofozoítos se alimentan de bacterias presentes en el medio ambiente y se multiplica por binaria fisión. Una característica única de Acanthamoeba es la presencia de finos y estrechos pseudópodos en forma de espinas llamado «acantopodia», que sobresalen de su superficie. Los trofozoítos varían en tamaño de 15 a 45μm y por lo general tienen un solo núcleo localizado en el centro, el núcleo es densamente teñido. El citoplasma es finamente granular y contiene numerosas mitocondrias, los ribosomas, vacuolas alimenticias y una vacuola contráctil. Los quistes son de doble pared y varían en tamaño de 10 a 29μm. La pared del quiste externo, el exoquiste, está arrugado con pliegues y ondulaciones que contienen proteínas y lípidos. La pared del quiste interno, el endoquiste, contiene celulosa y por lo tanto es ácido periódico de Schiff-positivo. Es estrellada, poligonal, oval, o esférica. Los poros u ostiolos, en el cruce del exoquiste y la endoquiste están cubiertos por opérculos convexo-cóncavos que se abren en el momento del desenquistamiento. Los quistes son también uninucleados y poseen un nucléolo densamente colocado en posición central. Los quistes pueden resistir la desecación durante más de 20 años. B. mandrillaris, así como Acanthamoeba solo tienen dos estadios de su ciclo de vida. El trofozoíto es pleomórfico y mide 12 a 60μm con una media de 30μm. Los trofozoítos por lo general son uninucleados, pero formas binucleadas pueden ser observadas. El núcleo se ubica centralmente, con un nucléolo denso, y en ocasiones los trofozoítos con 2 o 3 cuerpos nucleares se pueden observar, especialmente en los tejidos infectados. Los quistes también son uninucleados, más o menos esféricos y pueden variar en tamaño desde 12 hasta 30μm, con una media de 15μm. Bajo la luz del microscopio los quistes parecen ser de doble pared, con una pared exterior ondulada y una pared interior ronda. Balamuthia presenta dos tipos de locomoción; un tipo es el movimiento por la locomoción ameboideo típica en los cultivos, el segundo tipo presenta una locomoción tipo araña en donde los pseudópodos son piernas y están extendidos alimentándose en cultivo de células. B. mandrillaris desplaza sus pseudópodos de forma similar a una araña con una velocidad estimada de 0,15μ/s, es más lentas que cualquier otra ameba.
Diagnóstico clínico y métodos de laboratorio El examen bioquímico del LCR revela normal a bajo nivel de glucosa, pero aumento de los niveles de proteína y pleocitosis linfocititaria con menos de 500 células/mm3. B. mandrillaris en Perú, solo se ha aislado una vez de biopsia de piel y algunas veces del medio ambiente. Es difícil diferenciar B. mandrillaris de Acanthamoeba spp. en tejido fijado en formol e incrustado en parafina bajo el microscopio de luz porque tienen apariencia muy similar. Sin embargo, pueden ser diferenciados por técnicas de inmunohistoquímica mediante el uso anti-Acanthamoeba o anti-B. mandrillaris de sueros de conejo. Para el diagnóstico confirmatorio la técnica molecular del PCR es útil para identificar B. mandrillaris.
Métodos de diagnóstico: cultivo monoxénico y axénico Difícilmente los laboratorios clínicos realizan cultivos de AVL, por esta razón es importante establecer el diagnóstico histopatológico inicial, la sospecha debe realizarse cuando los resultados suelen dar negativo a los microorganismos típicos como bacterias y hongos y no reaccionar a las pruebas de leishmania u otra condición similar como TB cutánea. Para ello la biopsia de la lesión cutánea o LCR debe ser evaluada
rigurosamente. La muestra debe ser sembrada en medios básicos pero selectivos (monoxénico y cultivo celular) para AVL. El diagnóstico de EGA por Acanthamoeba se realiza por la visualización de amebas en extensiones de LCR o en cultivos ya sea monoxénico o celular. El mayor porcentaje de aislamientos ocurre en estadios relativamente precoces de la enfermedad cuando la ameba está confinada a la piel (en casos de lesión cutánea). Con el tiempo las amebas penetran en tejidos más profundos llegando a ingresar en el torrente sanguíneo y diseminarse a través de las paredes de los vasos. La exploración de la cavidad nasal (lavado nasal) también debe ser incluida como muestra para la búsqueda de AVL en los casos de sinusitis y/o lesiones nasales. Las amebas se visualizan en extensiones directas, teñidas con Giemsa, PAS y/o calcoflúor.
Patógeno: Ameba capaz de vivir como parásito o como ame...
Similar Free PDFs
Degrabada de parasitologia final
- 91 Pages

TRABAJO FINAL de parasitologia
- 43 Pages

Degrabada DE Biología
- 100 Pages

Apostila de parasitologia
- 80 Pages

Parasitologia de pequenos animais
- 68 Pages

Enterobiosis- parasitologia
- 5 Pages

Metodo de Richie - parasitologia
- 1 Pages

Questoes de Parasitologia - gabarito
- 13 Pages

Malaria - Parasitologia
- 9 Pages

Trichomonas parasitologia
- 3 Pages

Clases-de-parasitologia-5ta-unidad
- 30 Pages

Parasitologia Laboratorio
- 3 Pages

Parasitologia tema 2
- 3 Pages
Popular Institutions
- Tinajero National High School - Annex
- Politeknik Caltex Riau
- Yokohama City University
- SGT University
- University of Al-Qadisiyah
- Divine Word College of Vigan
- Techniek College Rotterdam
- Universidade de Santiago
- Universiti Teknologi MARA Cawangan Johor Kampus Pasir Gudang
- Poltekkes Kemenkes Yogyakarta
- Baguio City National High School
- Colegio san marcos
- preparatoria uno
- Centro de Bachillerato Tecnológico Industrial y de Servicios No. 107
- Dalian Maritime University
- Quang Trung Secondary School
- Colegio Tecnológico en Informática
- Corporación Regional de Educación Superior
- Grupo CEDVA
- Dar Al Uloom University
- Centro de Estudios Preuniversitarios de la Universidad Nacional de Ingeniería
- 上智大学
- Aakash International School, Nuna Majara
- San Felipe Neri Catholic School
- Kang Chiao International School - New Taipei City
- Misamis Occidental National High School
- Institución Educativa Escuela Normal Juan Ladrilleros
- Kolehiyo ng Pantukan
- Batanes State College
- Instituto Continental
- Sekolah Menengah Kejuruan Kesehatan Kaltara (Tarakan)
- Colegio de La Inmaculada Concepcion - Cebu


