TEMA 4B Enzimas Vitaminas PDF

| Title | TEMA 4B Enzimas Vitaminas |
|---|---|
| Course | Biología |
| Institution | Bachillerato (España) |
| Pages | 7 |
| File Size | 330.9 KB |
| File Type | |
| Total Downloads | 31 |
| Total Views | 157 |
Summary
Apuntes...
Description
BIOLOGIA 2º BACH
JORGE M. PPEREZ MARTINEZ
ENZIMAS Y VITAMINAS 1. ENZIMAS 1.1. Características generales y conceptos básicos 1.2. Estructura 1.3. Coenzimas 1.4. Centro activo 1.5. Especificidad enzimática 1.6. Actividad enzimática 1.7. Cinética enzimática 1.8. Factores que afectan a la actividad enzimática 1.9. Inhibición enzimática 1.10. Nomenclatura y clasificación 2. VITAMINAS. CONCEPTO Y CLASIFICACION
BIOLOGIA 2º BACH
JORGE M. PPEREZ MARTINEZ
1. ENZIMAS 1.1. Características generales y conceptos básicos Una enzima es una proteína globular con función catalítica ya que acelera las reacciones metabólicas disminuyendo la energía de actuación necesaria. Sus dos características más importantes son: -
Aunque un proceso esté catalizado por una enzima la cantidad de producto será la misma con un proceso más rápido. No se consumen, es decir, no se gastan. Se pueden utilizar infinitamente. Al finalizar la reacción habrá la misma cantidad de enzimas.
CATALISIS: proceso de aceleración de una reacción química por efecto de una sustancia llamada catalizador. E. ACTIVACION: es la energía que hay que suministrar a los reactivos para que la reacción química se produzca. Las enzimas reducen esta energía de activación sin alterar el equilibrio.
1.2. Estructura Según su composición química hay dos tipos de enzimas: -
Holoproteinas: formada solo por proteínas. Holoenzimas: formada por una apoenzima, parte polipeptídica, y por el cofactor, parte no proteica, que puede ser orgánico (coenzima) o inorgánico (ion metálico).
COFACTOR: componente no proteico necesario para la acción de una enzima.
1
BIOLOGIA 2º BACH
JORGE M. PPEREZ MARTINEZ
1.3. Coenzima Son biomoléculas orgánicas que intervienen en determinadas reacciones enzimáticas transportando grupos químicos. Son cofactores orgánicos y muchas son vitaminas. 1.4. Centro activo Región de la enzima formada por los aminoácidos que se unen al sustrato. *CARACTERISTICAS -
Región muy pequeña del volumen total de la enzima. Tiene estructura tridimensional que facilita el encaje del sustrato y dificulta que se unan otras moléculas. Formado por aminoácidos cuyos radicales tienen afinidad química por el sustrato, es decir, lo atraen y establecen enlaces con él. Hay dos tipos de aminoácidos en el centro activo: - Fijación: establece enlaces débiles con el sustrato. - Catalizadores: forman enlaces débiles o fuertes que provocan la ruptura de algunos enlaces del sustrato. 1.5. Especificidad enzimática
Entre la enzima y el sustrato existe una elevada especificidad. Los aminoácidos del centro activo poseerán una estructura complementaria al sustrato. Esto reduce la variedad de sustratos sobre las que puede actuar una enzima. Hay dos modelos: -
MODELO LLAVE-CERRADURA
Existe una complementariedad entre el sustrato y el centro activo perfecta. El centro activo es rígido. Año 1894.
-
MODELO ENCAJE INDUCIDO
Inicialmente no hay complementariedad entre el centro activo y el sustrato pero la enzima modifica su forma y se adapta al sustrato. Cuando el sustrato se transforma en producto, la enzima vuelve a su estado. Año 1958.
2
BIOLOGIA 2º BACH
JORGE M. PPEREZ MARTINEZ
1.6. Actividad enzimática
E+SE-SE+P La enzima y el sustrato se unen formando el complejo enzima-sustrato mediante enlaces débiles con los aminoácidos del centro activo y provoca la ruptura o unión de algunos enlaces del sustrato. Al final se liberan los productos y la enzima queda intacta. 1.7. Cinética enzimática Considerando la concentración de enzima constante, si aumenta la concentración de sustrato aumenta la velocidad de la reacción, ya que al haber más sustratos aumenta la probabilidad de encuentro entre enzima y sustrato. Llegará el momento en el que la velocidad no aumente (Vmáxima), decimos entonces que la reacción se ha saturado (todas las enzimas están saturadas).
CONSTANTE DE MICHAELIS-MENTEL (Km) Es la concentración de sustrato a la cual la velocidad de reacción es la mitad de la velocidad máxima. Depende de la afinidad que hay entre la enzima y el sustrato. Un bajo valor de Km indica que se consigue una alta eficacia catalítica incluso con bajas concentraciones de sustrato.
3
BIOLOGIA 2º BACH
JORGE M. PPEREZ MARTINEZ
1.8. Factores que afectan a la actividad enzimática *TEMPERATURA Si aumenta la temperatura también aumenta la movilidad de las moléculas por lo que habrá mayor probabilidad de encuentro entre enzima y sustrato aumentando la velocidad de la reacción. Existe una temperatura óptima que si es sobrepasada la enzima se desnaturaliza,, ya que es una proteína.
*PH Es similar a la temperatura pero existen dos valores entre los que la enzima es eficaz, si se sobrepasan se desnaturaliza. También existe un pH óptimo.
*CONCENTRACION DE SUSTRATO *CONCENTRACION DE ENZIMA *INHIBIDORES
1.9. Inhibición enzimática Un inhibidor es aquella sustancia que disminuye a actividad enzimática (medicamentos, venenos…). Hay dos tipos: *IRREVERSIBLE El efecto de inhibición es permanente ya que se une al centro activo mediante enlaces covalentes (envenenamiento).
4
BIOLOGIA 2º BACH
JORGE M. PPEREZ MARTINEZ
*REVERSIBLE Unión temporal entre el inhibidor y la enzima por enlaces débiles. No se destruye la actividad catalítica de la enzima. Hay dos tipos: -
Competitiva: el sustrato y el inhibidor compiten por unirse al centro activo ya que tienen la misma forma. Se reducirá la velocidad de ña reacción y sí aumenta la concentración de sustrato la acción del inhibidor es menor, aumenta la concentración de sustrato (antibióticos, medicamentos) No competitiva: el inhibidor se une a otro sitio de la enzima que no es el centro activo. Modifica su estructura tridimensional por lo que el sustrato no puede unirse. Aunque aumente la concentración de sustrato la acción del inhibidor no cambia.
-
1.10.
Nomenclatura y clasificación
Se nombra en muchos casos añadiendo el sufijo –asa al sustrato sobre el que actúa. Hay seis tipos: -
Oxidorreductasa: reacciones de oxidoreducción. Transferasas: transfieren radicales o grupos funcionales. Hidrolasas: provocan la hidrolisis (lipasa, pepsina). Liasas: unen o rompen enlaces con grupos funcionales. Isomerasas: crean isómeros (isomerización). Ligasas o sintetasas: unen sustratos consumiendo energía.
2. VITAMINAS Son moléculas orgánicas necesarias en cantidades muy pequeñas pero imprescindibles porque son precursoras de coenzimas. No las producimos, tenemos que ingerirlas en la dieta. *CLASIFICACIÓN -
HIDROSOLUBLES
Tienen naturaleza polar (se disuelven en agua), no se acumulan porque se eliminan por la orina. Los ejemplos más importantes son C, B9 y B12. -
-
-
C, ácido ascórbico: participa en la síntesis de las sustancias fundamentales de tejido conectivo del colágeno y la dentina. La carencia provoca la enfermedad del escorbuto. Esta enfermedad provoca problemas en la cicatrización, reparación ósea, provocando debilidad ósea y también produce una pérdida de peso. B9, ácido fólico: es una coenzima para la síntesis de ácidos nucleicos y formación de glóbulos rojos. Su carencia provoca anemia perniciosa y problemas en la maduración de glóbulos rojos. Esto provoca debilidad y pérdida de peso. B12, cianocobalamina: es coenzima en el metabolismo de aminoácidos. Su deficiencia produce anemia y espina bífida en el desarrollo embrionario.
5
BIOLOGIA 2º BACH
-
JORGE M. PPEREZ MARTINEZ
LIPOSOLUBLES
Son apolares y derivan todas del isopreno (lípido insaponificable) y son insolubles en agua pero solubles en disolventes apolares como las grasas. El exceso se acumula en las grasas y puede provocar toxicidad. Los ejemplos más importantes son A y D. -
-
A, retinol: interviene en la formación del pigmento del ojo. También mantiene los epitelios de la piel e intervienen en la formación del colágeno del hueso. Su carencia provoca ceguera nocturna, fragilidad en los huesos y retrasos en el crecimiento. D, calciferol: favorece la absorción del calcio intestinal y su fijación en huesos y dientes. Su carencia provoca raquitismo en niños y osteomalacia en adultos.
6...
Similar Free PDFs

TEMA 4B Enzimas Vitaminas
- 7 Pages

TEMA 3. Enzimas
- 9 Pages

Vitaminas
- 9 Pages

Vitaminas
- 26 Pages

Enzimas
- 8 Pages

Assignment 4b - HW 4b
- 1 Pages
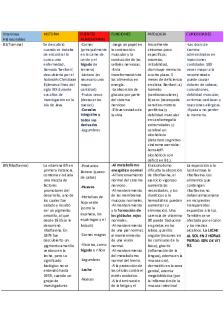
Tabla Vitaminas
- 12 Pages

Enzimas
- 12 Pages

Enzimas
- 1 Pages

TEMA 4 Vitaminas - Lecture notes 4
- 13 Pages

Coenzimas vitaminas
- 4 Pages
Popular Institutions
- Tinajero National High School - Annex
- Politeknik Caltex Riau
- Yokohama City University
- SGT University
- University of Al-Qadisiyah
- Divine Word College of Vigan
- Techniek College Rotterdam
- Universidade de Santiago
- Universiti Teknologi MARA Cawangan Johor Kampus Pasir Gudang
- Poltekkes Kemenkes Yogyakarta
- Baguio City National High School
- Colegio san marcos
- preparatoria uno
- Centro de Bachillerato Tecnológico Industrial y de Servicios No. 107
- Dalian Maritime University
- Quang Trung Secondary School
- Colegio Tecnológico en Informática
- Corporación Regional de Educación Superior
- Grupo CEDVA
- Dar Al Uloom University
- Centro de Estudios Preuniversitarios de la Universidad Nacional de Ingeniería
- 上智大学
- Aakash International School, Nuna Majara
- San Felipe Neri Catholic School
- Kang Chiao International School - New Taipei City
- Misamis Occidental National High School
- Institución Educativa Escuela Normal Juan Ladrilleros
- Kolehiyo ng Pantukan
- Batanes State College
- Instituto Continental
- Sekolah Menengah Kejuruan Kesehatan Kaltara (Tarakan)
- Colegio de La Inmaculada Concepcion - Cebu




