proteinas,aa y vitaminas PDF

| Title | proteinas,aa y vitaminas |
|---|---|
| Author | Teresa Ortiz |
| Course | Bioquimica |
| Institution | Universidad Autónoma de Tamaulipas |
| Pages | 26 |
| File Size | 1.4 MB |
| File Type | |
| Total Downloads | 6 |
| Total Views | 172 |
Summary
proteinas,aa y vitaminas...
Description
PROTEINAS Y AMINOACIDOS
La diversidad de funciones que hacen posible la vida requiere la acción de t caracterizan a los seres vivos. Macromoleculas intracelulares mas abundantes Unidas basica los aminoácidos, son 20 esecnciales o no escenciales , unidos por enlace peptidico Formados por C-HO-N-S •
FUNCIONES: o
Las proteínas también trasportan y regulan el flujo de moléculas y electrones a través de las membranas; de esta manera hacen posible la transmisión de información entre células y órganos.
o
El sistema inmunitario produce otro tipo partículas de proteínas, los anticuerpos, capaces de distinguir las moléculas propias de las ajenas. PROTEINAS Ac
o
Son también los componentes principales de los músculos y de otros sistemas capaces de trasformar la energía química de los alimentos en trabajo mecánico. Las proteínas controlan la expresión de las actividades celulares, mediante su unión a secuencias especificas del DNA. Acelera transformaciones químicas Estructural: Determinan la estructura celular y extracelular; cabellos y tendones La información contenida en el DNA es transformada por la maquinaria celular en la secuencia de aminoácidos de las proteínas.
o o o o
o
Dentro de las células un tipo particular de proteínas, las enzimas, aceleran reacciones químicas para que se lleven a cabo a una velocidad compatible.
•
Catalizador (enzima)
Todas la reacciones que involucran transacciones de energía requieren la acción de las proteínas.
LAS PROTEINAS SON POLIMEROS DE ORIGEN GENTICO CON UNA CONFROMACIÓN ESPACIAL DEFINIDA o Los seres humanos son capaces de sintetizar unas 50,000 proteinas distintas LAS PROTEINAS SON CADENAS DE L-AMINOACIDOS o
Las proteínas son polímeros lineales de aminoácidos unidos entre si mediante enlaces peptídicos.
o
20 son comunes en las proteínas de todos los seres vivos. Todos los aminoácidos contienen grupos ionizables.
o
L-aminoácidos: son los que resultan relevantes para el ser humano y se denominan proteinogénicos y dentro de los proteinogénicos, se encuentran los L-aminoácidos que se diferencian en función de su estructura desde el punto de vista bioquímico y de cómo están estructurados.
o
D-aminoácidos: Todos los seres vivos son casi en exclusiva formadas por los L-aminoácidos; si bien, también se agrupan en D-aminoácidos, los cuales están presentes en algunos antibióticos producidos por hongos.
o
En todos los AA proteicos, excepto en la glicina (Gly), el carbono α es asimétrico y por lo tanto, son ópticamente activos.
Esto indica que existen dos enantiómeros (isómeros ópticos), uno de la serie D y otro de la serie L. Los AA proteicos son invariablemente de la serie L ***]*El carbono alfa de los aminoácidos esta unido a tres sustituyente*** Grupo carboxilo pK 4 –COOH Grupo amino básico pK 7.4 –NH2 Un átomo de hidrogeno H+
El cuarto sustituyente es un radical (R)
•
En algunos casos muy concretos se pueden encontrar AA de la serie D: en los peptidoglucano de la pared celular, en ciertos péptidos con acción antibiótica y en péptidos opioides de anfibios y reptiles.
•
Cuando un ser vivo se muere, sus AA (de la serie L) experimentan un proceso de racemización (se van convirtiendo poco a poco en una mezcla racémica con Daminoácidos y L-aminoácidos).
•
Este proceso ocurre con una velocidad característica y, en algunos casos, se puede estimar de manera aproximada la fecha de la muerte a partir del contenido en Daminoácidos.
Las proteínas son L – aminoácidos Las proteínas son polímeros lineales de aminoácidos unidos entre si mediante enlaces peptídicos Existen un gran numero de aminoácidos en la naturaleza, de origen biosintetico; solo 20 son comunes en las proteínas de todos los seres vivos.
LAS PROTEINAS SON POLIMEROS CONFORMACION ESPACIAL DEFINIDA o o o
DE
ORIGEN
GENETICO
CON
UNA
Los seres humanos son capaces de sintetizar alrededor de 50 000 proteínas distintas. La información necesaria para construir estas cadenas se encuentra en el material genético de las células, el DNA. Especies iónicas de los aminoácidos al variar el pH. R representa a la cadena lateral.
o o o
o o
Los aminoácidos son iones dipolares. Coexisten cargas positivas y negativas. Hay un valor particular de pH, llamado punto isoeléctrico (pl) en el que la carga neta del aminoácido es cero. Los cuatro enlaces de Ca adoptan una estructura tetraédrica. Existen dos maneras de acomodar cuatro sustituyentes diferentes en los vértices del tetraedro: LD RS Enantiómeros
o
o
•
A estas dos configuraciones espaciales se les denomina D y L. El Ca de los aminoácidos es quiral (del griego xeip, cheir, que significa mano), ya que sus cuatro sustituyentes pueden adoptar estas dos configuraciones espaciales. Los sistemas biológicos son esteroespecificos (Producen solo el isómero L) de los aminoácidos
En ciertas ocasiones algunos organismos sintetizan D- aminoácidos.
Todas las formas de vida en el planeta utilizan el isómero L para formas sus proteínas *Clasificación de los aminoácidos a partir de su estructura química y según la polaridad de las cadenas laterales de los mismos. Los AA son excelentes amortiguadores, gracias a la capacidad de disociación del grupo carboxilo, del grupo amino y de otros grupos ionizables de sus cadenas laterales (carboxilo, amino, imidazol, fenol, guanidino, etc).
GRUPO CARBOXILO Desde el punto de vista químico, los aminoácidos (AA) son ácidos orgánicos con un grupo amino en posición alfa Según esta definición, los cuatro sustituyentes del carbono alfa (Cα) en un aminoácido son: 1. 2. 3. 4.
El grupo carboxilo Un grupo amino Un átomo de hidrógeno Una cadena lateral R, que es característica de cada AA Constituye una excepción el AA prolina, con un anillo pirrolidínico, que puede considerarse como un aaminoácido que está N-sustituído por su propia cadena lateral (Figura de la DERECHA).
H
H
H
H
pK≈
pK≈ Recibe
Da
ACI
NEU
ALCAL
A pH bajo (ácido), los aminoácidos se encuentran mayoritariamente en su forma catiónica (con carga positiva), mientras que a pH alto (básico) se encuentran en su forma aniónica (con carga negativa). Para valores de pH intermedios, como los propios de los medios biológicos, los aminoácidos se encuentran habitualmente en una forma de ion dipolar o zwitterión (con un grupo catiónico y otro aniónico Estos 20 aminoácidos presentan la misma estructura general. Todos los aminoácidos contienen grupos ionizables, por lo que al variar la acidez de la solución se observan diferentes especies iónicas cuya carga neta varia en el pH.}
Los aminoácidos son iones dipolares (existen cargas + -)
AMMINOACIDOS ALLIFATICOS En esta grupo se encuadran los aminoácidos cuya cadena lateral es alifática, es decir una cadena hidrocarbonada. o
o
Glicina Su cadena lateral es un átomo de H+ El Carbono α tiene dos sustituyentes iguales este no es quiral La glicina es el más pequeño de los aminoácidos Es ambivalente, lo que significa que puede estar dentro o fuera de la molécula de proteína. En solución acuosa a o cerca de pH neutro, glicina existirá predominantemente como el zwitterion Alanina,Valina,Leucina y Isolecina: Son no polares, presentan un CH2 no polar. Las cadenas laterales de estos residuos no contienen átomos electronegativos (no son polares) e insolubles en agua
AMINOACIDOS AROMATICOS
En esta grupo se encuadran los aminoácidos cuya cadena lateral posee un anillo aromático. La fenilalanina es una alanina que lleva unida un grupo fenílico. Los dobles enlaces conjugados absorben radiacion en el ultravioleta, la reemision de esta radiacion, conocida como fluorescencia. La tirosina es como la fenilalanina con un hidroxilo en su anillo aromático, lo que lo hace menos hidrofóbico y mas reactivo; son donaodres de puentes de hidrogeno. El OH de la tirosina y el anillo pirrolico del triptofano son donadores potenciales de puente de hidrógeno
El triptófano tiene un grupo indol y es el menos frecuente de las proteinas, su cadena lateral es mas grandey flourescente. Los tres presentan dobles enlaces conjugados que presentan los anillos de ello.
La prolina, es un polar; también tiene una cadena lateral de naturaleza alifática, pero difiere de los demás aminoácidos en que su cadena lateral está unida tanto al carbono alfa como al nitrógeno del grupo amino. AA AZUFRADOS Hay dos aminoácidos cuyas cadenas laterales poseen átomos de azufre, son la: Cisteína, que posee un grupo sulfhidrilo Metionina, que posee un enlace tioéster o El grupo tiol de la cisteína es el mas reactivo de todas las cadenas laterales y se ioniza con un PK entre 9 y 9.5 , dando lugar al anion tiolato que es lea especie reactiva o Interacción entre dos cisteínas para formar una ‘’cisteína’‘ o puente disulfuro o No polar o El azufre que contienen es un nucleofilo débil pero no puede ser protonado AA HIDROXILADOS Otros dos aminoácidos tienen cadenas alifáticas hodroxiladas, la serina y la treonina. El grupo hidroxilo hace de estos aminoácidos mucha más hidrofílicos y reactivos. Sus cadenas laterales son pequeñas y tiene un grupo funcional alcohol por lo que participa como donador de puentes de hidrogeno. AA BASICOS Dentro de los aminoácidos con cadenas laterales muy polares encontramos tres aminoácidos básicos: lisina y arginina ( las cadenas laterales presentan metilenos hidrófobos y una amina básica con pk cerca de 11 y carga positiva a ph fisiológico) e histidina( tiene una cadena lateral un amidazol cuyo pk es de 6.5, donador y acepta puentes de hidrogeno. Participa en la transferencia de protones que catalizan algunas enzimas,debido a la forma protonada y desprotonada coesxisten al pH neutro ) AA ACIDOS Y SUS AMIDAS En este grupo encontramos dos aminoácidos con cadenas laterales de naturaleza ácida y sus amidas correspondientes.
Estos son el ácido aspártico y el ácido glutámico (Debido a su pH COOH se encuentra como COO- da lugar a bases conjugadas denominados aspartato y glutamato, para resaltar que sus cadenas laterales están cargadas negativamente a pH fisiológico(alcalino).Ambos producen isóaspartato, relacionado con el envejecimiento de las proteínas. Tienen pK de cercano a 4. Los derivados sin carga de estos dos aminoácidos son la asparagina y la glutamina que contienen un grupo amida terminal en lugar del carboxilo libre. Son las amida del aspartato y el glutamato.
Estructura y propiedades del enlace peptídico, cadena polipeptídica
Los L- aminoácidos se encuentran unidos en las proteínas mediante el enlace covalente del grupo carboxilo de un aminoácido con el grupo amino. En esta reacción de condensación se forma una amida, que une los dos aminoácidos para formar el enlace peptídico Durante la biosíntesis la unión secuencial de varios aminoácidos al extremo carboxilo genera una cadena polipeptidica. En el inicio se encuentra un aminoácidos con el grupo amino libre +. Al final de la cadena un aminoácido con el grupo carboxilo libre – La mayoría de los enlaces peptídicos en las proteínas se encuentran en trans Ya que en esta conformación se presentan menos impedimentos estéricos con otras cadenas de las proteínas.
LOS NO ESENCIALES EL CUERPO LOS PUEDE SINTETIZAR
Extension y variedad de las cadenas polipeptídicas Monomericas: formadas por una sola cadena Oligomericas: en la que la proteina funcional requiere de la asociación no covalente de dos o mas cadenas. PURIFICACIÓN DE PROTEINAS Una bacteria como E. coli produce 3000 proteinas diferentes Mientras que algunas celulas del ser humano sintetizan cerca de 20 000 La abundancia de cada proteina varian entre celulas y tejidos Para estudiar las propiedades de un proteína es necesario purificarla, es decir separarla de las otras proteínas y demás componentes celulares Se separan por fraccionamiento debido a diferencias de tamaño, forma, carga y solubilidad Lisozima, degrada la pared celular
PRECIPITACIÓN SELECTIVA La solubilidad de las proteínas depende de la concentración de sales , pH, temperatura y polaridad del solvente A concentraciones bajas de sal, la solubilidad de las proteínas aumenta y a concentraciones altas, la solubilidad baja, causano la precipitación de la enzima. La precipitacion causada por algunas sales sulfato de amonio es reversible; al eliminar la sal por dialisis y otros metodos, las proteinas se solubilizan de nuevo y recuperan sus propiedades originales. Es ideal ya que pueden permanecer en ese estado por meses. CROMATOGRAFÍA
Proceso en que una solución conocida como fase móvil, se percola a través de una resina, lladamada fase estacionaria, que retrasa el avance de los componentes en la fase móvil Las moleculas muy grandes no puden penetrar las cuentas; ademas debido a que son excluidas del solvente en el interior de la resina, son las primeras en salir de la columna Cromatografia de intercambio ionico, de filtración en gel, de exclusión molecular, de afinidad, etc. DIALISIS La diálisis es un tipo de filtración en donde las moléculas se separan gracias a su paso a través de una membrana semipermeable Se introduce una bolsa formada por la membrana y se coloca en una solución con el amortiguador en el cual se desea colocar la proteína, después de un tiempo, la concentración se equilibra; pero las macromoléculas quedan dentro del saco ELECTROFERESIS La electroforesis es el proceso mediante las proteínas migran según su carga en un campo eléctrico Determina el numeor de proteinas diferentes en una preparación, asi como estima su peso molecular o el punto isoelectrico ISOELECTROENFOQUE Es la técnica donde que se utiliza para determinar el punto isoeléctrico (PI) de las proteínas(pH neutro) En este caso el medio en el que migra la proteína es un gel poliacrilamida que contiene un gradiente de pH formado por anfolitos ácidos o bases orgánicos de bajo peso molecular Secuencia de aminoácidos y estructura primaria de las proteinas Frederick sanger, secuencia de aminoácidos de la insulina. Moléculas purrifcadas de la misma fuente y con la misma función tienen enlace covalente, conocido como estructura primaria Primer para obtener estructura primaria es la purificación, después se fragementan usando proteinasas o métodos químicos Conformación nativa de las proteinas
Una población de ´proteinas con la misma estructura covalente, adoptan una forma trdimensional similar, llamada conformación nativa. La mejor prueba de homogeneidad estructural del estado nativo es la formación de cristales(la primera observación fue en la proteina hemoglobina y después la enzima ureasa)
CONFIGURACIÓN E INTERACCIONES NO COVALENTES El plegamiento de proteínas y la interacción de estas con sus ligandos están moldeados por restricciones fisicoquímicas Es importante por lo tanto estudiar las interacciones no covalentes entre los átomos de la proteína y entre estos y los átomos del solvente. Deberemos considerar que el agua es el solvente universal, este determina la estructura y organización de todos los componentes celulares, debido a las interacciones no covalentes entre el agua y las macromoléculas. La formación de enlaces restringe la distancia y el ángulo de unión entre núcleos atómicos. En moléculas pequeñas el enlace covalente da la estructura tridimensional y en las macromoléculas la rotación de los atomos da lugar a arreglos en el espacio. CONFORMACIONES QUE PUEDEN ADOPTAR UNA CADENA POLIPEPTIDICA Numero total de conformaciones, formula: 1. nªª n: es el numero de conformaciones que puede adoptar una cadena polipeptídica. aa: el numero de aminoácidos en la cadena Ejemplo: se tiene 2 conformaciones por residuo en una cadena de 20 aminoácidos= 2²° = 1048576 conformaciones posibles. En relación al numero de conformaciones que puede adoptar una proteína debemos de comprender que entre mayor sea es energéticamente desfavorable ya que disminuye la entropía configuracional de la cadena. Por lo tanto para que una configuración particular predomine sobre las demás es necesario que las interacciones que estabilizan esta conformación sea de una magnitud mayor a –T Sconf. Interacciones de van der Waals y repulsión de corto alcance (efectos estéricos) •
Las fuerzas de Van der Waals(son obicuas) se llaman así en honor al físico holandés Johannes Van der Waals.
•
Estas fuerzas son las responsables de muchos fenómenos físicos y químicos como la adhesión, rozamiento, difusión, tensión superficial y la viscosidad.
•
La distancia a la que no existe atracción o repulsión neta se conoce como radio de Van der Waals y determina la distancia mínima entre dos átomos que no están enlazados.
¿Qué son las Fuerzas de Van Der Waals? Lo primero que tenemos que saber es que las sustancias químicas son formadas por moléculas compuestas de átomos, unidos entre si por medio de enlaces químicos (covalente, iónico o metálico).
La energía almacenada por estos enlaces, sumada a la red molecular de todo el conjunto de moléculas que forma la sustancia, determina la estabilidad de estos enlace. Piensa que si en varias moléculas, por ejemplo con enlaces covalente, no hubiera ninguna fuerza de unión entre ellas, estarían moviéndose libremente y por lo tanto siempre estarían en estado gaseoso (movimiento libre de las moléculas). Ya sabemos que eso no es así, porque pueden estar también en estado sólido o líquido (no se mueven libremente), y esto quiere decir que habrá algún tipo de conexiónunión entre las moléculas. Ha este tipo de interacción o fuerza es lo que se conoce como fuerzas de interacción intermoleculares o de van der Waals Las fuerzas de van der Waals son fuerzas de estabilización molecular (dan estabilidad a la unión entre varias moléculas), también conocidas como atracciones intermoleculares o de largo alcance y son las fuerzas entre moléculas (fuerzas entre molecula-molecula). Son fuerzas mas débiles que las internas que unen la molécula ya que dependen exclusivamente del tamaño y forma de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no se las puede considerar un enlace, como el enlace covalente o iónico, solo se las considera una atracción Para tener una idea de la poca fuerza que tienen, si un enlace covalente tuviera una fuerza de 100, las de Van der Waals serían de valor 1 (100 veces menor). De hecho las fuerzas de van der Waals son las fuerzas atractivas o repulsivas entre moléculas (o entre partes de una misma molécula) distintas a aquellas debidas a un enlace (covalente, iónico o metálico). Incluyen a atracciones entre átomos, moléculas y superficies fuera de los enlaces normales TIPOS DE FUERZA: I.
DIPOLO-DIPOLO
Cuando dos moléculas polares (dipolo) se aproximan, se produce una atracción entre el polo positivo de una de ellas y el negativo de la otra . Se forma entre un dipolo positivo de una molécula polar con el dipolo negativo de otra polar. Una atracción dipolo-dipolo es una interacción no covalente entre dos moléculas polares. Las moléculas que son dipolos se atraen entre sí cuando la región positiva de una está cerca de la región negativa de la otra. Podríamos decir que es similar al enlace iónico pero mucho más débil. II.
INTERACCIONES IONICAS O DIPOLO-DIPOLO INDUCIDO
En ciertas ocasiones, una molécula polar (dipolo), al estar próxima a otra no polar, induce en ésta un dipolo transitorio, produciendo una fuerza de atracción intermolecular llamada dipolo-dipolo ind...
Similar Free PDFs

Vitaminas y minerales
- 11 Pages

Vitaminas
- 9 Pages

Vitaminas
- 26 Pages

Vitaminas y Minerales
- 14 Pages

proteinas,aa y vitaminas
- 26 Pages
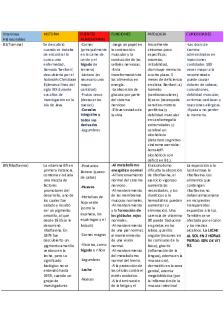
Tabla Vitaminas
- 12 Pages

Manual De Vitaminas Y Minerales
- 42 Pages

tabla vitaminas y minerales pdf
- 6 Pages

Power point Vitaminas y minerales
- 57 Pages

Coenzimas vitaminas
- 4 Pages

Vitaminas - Bioquímica
- 2 Pages

Vitaminas generalidades
- 10 Pages

TEMA 4B Enzimas Vitaminas
- 7 Pages

Cuadro de Vitaminas nn,,,
- 5 Pages
Popular Institutions
- Tinajero National High School - Annex
- Politeknik Caltex Riau
- Yokohama City University
- SGT University
- University of Al-Qadisiyah
- Divine Word College of Vigan
- Techniek College Rotterdam
- Universidade de Santiago
- Universiti Teknologi MARA Cawangan Johor Kampus Pasir Gudang
- Poltekkes Kemenkes Yogyakarta
- Baguio City National High School
- Colegio san marcos
- preparatoria uno
- Centro de Bachillerato Tecnológico Industrial y de Servicios No. 107
- Dalian Maritime University
- Quang Trung Secondary School
- Colegio Tecnológico en Informática
- Corporación Regional de Educación Superior
- Grupo CEDVA
- Dar Al Uloom University
- Centro de Estudios Preuniversitarios de la Universidad Nacional de Ingeniería
- 上智大学
- Aakash International School, Nuna Majara
- San Felipe Neri Catholic School
- Kang Chiao International School - New Taipei City
- Misamis Occidental National High School
- Institución Educativa Escuela Normal Juan Ladrilleros
- Kolehiyo ng Pantukan
- Batanes State College
- Instituto Continental
- Sekolah Menengah Kejuruan Kesehatan Kaltara (Tarakan)
- Colegio de La Inmaculada Concepcion - Cebu

